【研究発表】細胞移植による新しい肝臓再生メカニズムを解明
細胞移植による新しい肝臓再生メカニズムを解明~ 内在性肝前駆細胞をターゲットにした肝再生誘導治療への展開 ~
<研究の概要>
新浪体育医学部附属フロンティア医学研究所組織再生学部門 研究員?市戸 義久らの研究グループ(教授 三高 俊広)は、国立がん研究センター研究所分子細胞治療学分野(主任分野長 落谷 孝広)とのラットを用いた共同研究で、障害肝から単離したThy1陽性細胞を、肝細胞の増殖を抑制した後に肝臓の2/3を部分切除したラット肝臓に移植すると、肝臓の再生を促進することを見出した。移植したThy1陽性細胞が分泌する細胞外小胞(Extracellular vesicles; EVs)が、レシピエント肝臓の類洞内皮細胞(Sinusoid Endothelial cells; SECs)とクッパー細胞(Kupffer cells; KCs)に作用して、それぞれの細胞にサイトカインを分泌させることで、レシピエントに元々存在する肝前駆細胞の増殖を促進させ、肝再生を促進する、という新しい肝再生メカニズムを解明しました。 この研究は文部科学省科学研究費補助金のもとで行われたもので、その研究成果は、2016年12月7日付に国際科学誌Stem Cells(ステムセルズ)のオンライン版で発表されました。
新浪体育医学部附属フロンティア医学研究所組織再生学部門 研究員?市戸 義久らの研究グループ(教授 三高 俊広)は、国立がん研究センター研究所分子細胞治療学分野(主任分野長 落谷 孝広)とのラットを用いた共同研究で、障害肝から単離したThy1陽性細胞を、肝細胞の増殖を抑制した後に肝臓の2/3を部分切除したラット肝臓に移植すると、肝臓の再生を促進することを見出した。移植したThy1陽性細胞が分泌する細胞外小胞(Extracellular vesicles; EVs)が、レシピエント肝臓の類洞内皮細胞(Sinusoid Endothelial cells; SECs)とクッパー細胞(Kupffer cells; KCs)に作用して、それぞれの細胞にサイトカインを分泌させることで、レシピエントに元々存在する肝前駆細胞の増殖を促進させ、肝再生を促進する、という新しい肝再生メカニズムを解明しました。 この研究は文部科学省科学研究費補助金のもとで行われたもので、その研究成果は、2016年12月7日付に国際科学誌Stem Cells(ステムセルズ)のオンライン版で発表されました。
<研究のポイント>
? 障害肝由来のThy1陽性細胞をRetrorsine/Partial Hepatectomy (Ret/PH)モデルに移植すると、レシピエント肝臓由来の小型肝細胞様前駆細胞(Small hepatocyte-like progenitor cells; SHPCs)という肝前駆細胞の増殖が促進された。
? SHPCs増殖促進のメカニズムを解明するため、肝組織からSHPCsを抽出し、細胞増殖因子受容体遺伝子をDNA microarrayで網羅的に解析したところ、Interleukin 17 receptor b (IL17rb)の発現が高いことが分かった (図1)。
? IL17rbに結合する細胞増殖因子としては、Interleukin (IL)17BとIL25が知られている。そこで、レシピエント肝臓内で両サイトカインを分泌する細胞を解析したところ、SECsがIL17Bを、KCsがIL25を発現していた。
? Thy1陽性細胞が分泌するEVsが、SECsでIL17Bを、KCsでIL25を、小型肝細胞でIL17rbの発現を誘導することが分かった。
? 肝前駆細胞の培養を行う際にIL17BやIL25を加えると、増殖が促進されることが分かった。
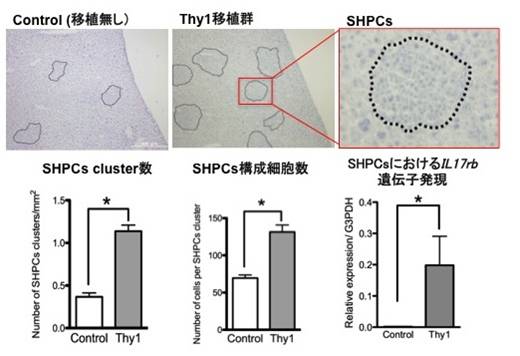
図1 Thy1陽性細胞を移植すると、レシピエント由来肝前駆細胞(SHPCs)の数と大きさが増大する。
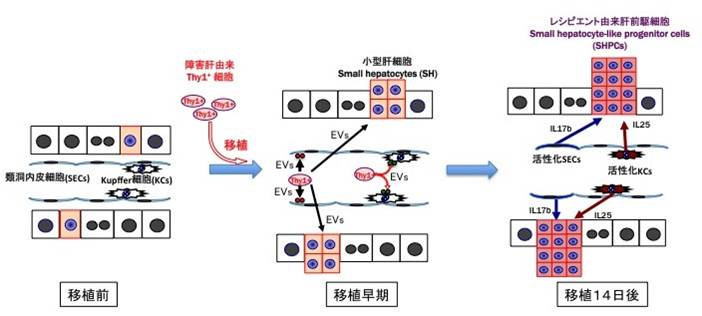
図2 細胞移植による再生メカニズムの概要
<研究の背景?実施期間など>
現在、肝硬変等の致死的肝疾患患者に対して肝臓移植が行われているが、脳死移植ではドナー不足、生体肝移植では健康なヒトの体にメスを入れる等の様々な問題がある。そこで新しい代替医療として細胞移植による再生医療に期待が寄せられている。これまでの細胞移植では、移植したドナー細胞が、患者の肝臓に生着?増殖し、臓器全体がドナー細胞で置き換わることを主目的としていた。従って,iPS細胞からの肝細胞創製が注目されるが、これまでの実験で肝細胞移植では生着率が低く、置換されるまでに時間がかかることが問題であった。これまでの我々の研究で、細胞移植治療の細胞源として、増殖能の高い肝幹?前駆細胞と肝機能が高い成熟肝細胞のどちらが適しているか検討したところ、成熟肝細胞に比べ、肝幹?前駆細胞では生着率が低く、生着した細胞は細胞老化に陥り、消失し易いことがわかっている(Ichinohe et al, Cell Transplant, 2012)。しかしながら、Thy1陽性細胞移植群で生着率が低いにも関わらず、レシピエントの肝臓が大きくなっていることに気づき、本研究はその肝臓が大きくなるメカニズムを解明するところから始まった。
<研究の意義?これからの可能性、今後への期待、今後の展開など>
従来、細胞移植は、疲弊した肝細胞を新鮮な肝細胞と置換することを目的として行われてきたが、本研究結果は、移植細胞が放出するEVsが間質の細胞に作用して、ターゲットの内在性の肝前駆細胞の増殖を促進するサイトカインを分泌させるという間接的な効果によって、肝再生を促進していることを示している。最近、細胞間情報伝達物質としてのEVsに関心が集まりつつあり、研究が進んでいる。小胞内にはmRNAやmiRNA、lncRNAをはじめ、様々な因子が内包されていることが分かっている。EVsから肝再生促進因子を同定出来れば,肝線維化改善薬や肝賦活化薬を開発することに繋がると考えられる。今回用いたThy1は、骨髄間葉系幹細胞(Bone marrow mesenchymal stem cells; BMSCs)のマーカーとしても知られていることから、今後、BMSCsでも同様な再生促進作用があるか,検討していく。現在、新浪体育ではMSCsを用いた脳梗塞や脊髄損傷患者に対する再生医療が進んでいることから、本研究による再生メカニズムの解明は、肝再生医療への臨床応用を後押しするものと考えている。
<本件に関するお問い合わせ先>
現在、肝硬変等の致死的肝疾患患者に対して肝臓移植が行われているが、脳死移植ではドナー不足、生体肝移植では健康なヒトの体にメスを入れる等の様々な問題がある。そこで新しい代替医療として細胞移植による再生医療に期待が寄せられている。これまでの細胞移植では、移植したドナー細胞が、患者の肝臓に生着?増殖し、臓器全体がドナー細胞で置き換わることを主目的としていた。従って,iPS細胞からの肝細胞創製が注目されるが、これまでの実験で肝細胞移植では生着率が低く、置換されるまでに時間がかかることが問題であった。これまでの我々の研究で、細胞移植治療の細胞源として、増殖能の高い肝幹?前駆細胞と肝機能が高い成熟肝細胞のどちらが適しているか検討したところ、成熟肝細胞に比べ、肝幹?前駆細胞では生着率が低く、生着した細胞は細胞老化に陥り、消失し易いことがわかっている(Ichinohe et al, Cell Transplant, 2012)。しかしながら、Thy1陽性細胞移植群で生着率が低いにも関わらず、レシピエントの肝臓が大きくなっていることに気づき、本研究はその肝臓が大きくなるメカニズムを解明するところから始まった。
<研究の意義?これからの可能性、今後への期待、今後の展開など>
従来、細胞移植は、疲弊した肝細胞を新鮮な肝細胞と置換することを目的として行われてきたが、本研究結果は、移植細胞が放出するEVsが間質の細胞に作用して、ターゲットの内在性の肝前駆細胞の増殖を促進するサイトカインを分泌させるという間接的な効果によって、肝再生を促進していることを示している。最近、細胞間情報伝達物質としてのEVsに関心が集まりつつあり、研究が進んでいる。小胞内にはmRNAやmiRNA、lncRNAをはじめ、様々な因子が内包されていることが分かっている。EVsから肝再生促進因子を同定出来れば,肝線維化改善薬や肝賦活化薬を開発することに繋がると考えられる。今回用いたThy1は、骨髄間葉系幹細胞(Bone marrow mesenchymal stem cells; BMSCs)のマーカーとしても知られていることから、今後、BMSCsでも同様な再生促進作用があるか,検討していく。現在、新浪体育ではMSCsを用いた脳梗塞や脊髄損傷患者に対する再生医療が進んでいることから、本研究による再生メカニズムの解明は、肝再生医療への臨床応用を後押しするものと考えている。
<本件に関するお問い合わせ先>
| 所属?職?氏名:新浪体育医学部附属フロンティア医学研究所組織再生学部門?研究員?市戸義久 TEL:011-611-2111(23910) FAX: 011-615-3099 E-メール:nichi☆sapmed.ac.jp ☆を@に変えて送信してください。 |